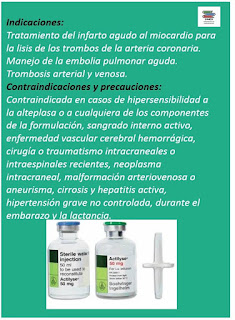
¿Cuándo se debe notificar RAMS?

Para el caso de profesionales de salud e instituciones prestadoras de servicios de salud pública y privada Para las reacciones adversas “no serias” se debe notificar en un máximo de 10 días hábiles a partir de la fecha en que se identificó el evento adverso. Para las reacciones adversas serias (graves) o amenaza de vida, inesperados, medicamentos de reciente comercialización y medicamentos de reciente incorporación a los listados institucionales se debe notificar en un máximo de 72 horas a partir de la fecha en que se identificó el evento adverso. Para los casos de “muerte” (incluye aquellos por causas no especificadas), se debe notificar en un máximo de 24 horas a partir de la fecha en que se identificó el evento adverso.