Entradas
Mostrando entradas de febrero, 2019
¿Que son los Medicamentos esenciales?
- Obtener enlace
- X
- Correo electrónico
- Otras aplicaciones

Se consideran como esenciales los medicamentos que cubren las necesidades de atención de salud prioritarias de la población. Su selección se hace atendiendo a la prevalencia de las enfermedades y a su seguridad, eficacia y costoeficacia comparativa. Se pretende que, en el contexto de los sistemas de salud existentes, los medicamentos esenciales estén disponibles en todo momento, en cantidades suficientes, en las formas farmacéuticas apropiadas, con una calidad garantizada, y a un precio asequible para las personas y para la comunidad. Por lo que la gestión del suministro de medicamentos a los usuarios de los servicios de salud deberán a fin de garantizar una atención oportuna y de calidad a los problemas de salud prioritarios de la población en general. Sin embargo persisten problemas de suministro que tienen una determinación social dada por la estructura económica, política y cultural de la sociedad con un modelo médico hegemónico biologicista, individual, asistencial...
Conclusión de la revisión de la EMA por la presencia de Niitrosaminas en los medicamentos denominados “SARTANES”.
- Obtener enlace
- X
- Correo electrónico
- Otras aplicaciones

El CHMP ha concluido la revisión realizada por la presencia de nitrosaminas en los medicamentos del grupo de los “ sartanes ” incluyendo valsartan ,c andesartan , irbesartan , losartan y olmesartan . El procedimiento de revisión, denominado arbitraje, en el Comité de Medicamentos de Uso Humano (CHMP) de la EMA que ha concluido la semana pasada. La revisión ha afectado a los medicamentos que tienen como principio activo candesartán, irbesartán, losartán, olmesartán y valsartán, todos ellos pertenecientes a una clase de medicamentos llamados sartanes (también conocidos como antagonistas de los receptores de la angiotensina II). Estos medicamentos se utilizan para tratar a pacientes con hipertensión arterial y pacientes con enfermedad cardíaca o renal. Actúan bloqueando la acción de la angiotensina II, una hormona que contrae los vasos sanguíneos y hace que aumente la presión arterial. La revisión del CHMP comenzó el 5 de julio de 2018 solo para valsartán, pe...
#UsoMedicamento:Alteplasa.Trombolítico, Activa el paso de plasminógeno a plasmina
- Obtener enlace
- X
- Correo electrónico
- Otras aplicaciones
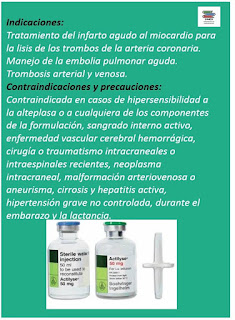
#UsoAlteplasa Trombolítico, Activa el paso de plasminógeno a plasmina, que hidroliza las redes de fibrina. Se usa en el Tratamiento fibrinolítico en el infarto agudo de miocardio. Indicaciones terapéuticas Alteplasa 1) Tto. trombolítico en el IAM: - Régimen de dosificación de 90 min. (acelerado): para pacientes en los cuales el tto. puede iniciarse dentro de las 6 h después de la presentación de los síntomas. - Régimen de dosificación de 3 h: para pacientes en los cuales el tto. puede iniciarse entre las 6 y 12 h después de la presentación de los síntomas, siempre que el diagnóstico esté claramente confirmado. Alteplasa ha demostrado reducir la mortalidad al cabo de 30 días en pacientes con IAM. 2) Tto. trombolítico en embolia pulmonar masiva aguda con inestabilidad hemodinámica. El diagnóstico deberá ser confirmado, siempre que sea posible, mediante medios objetivos como p.ej. angiografía pulmonar o procedimientos no invasivos como la gammagrafía isotópica pulmonar. No ha...
La suspensión de la Nimesulida en varios países de latinoamerica
- Obtener enlace
- X
- Correo electrónico
- Otras aplicaciones

En varios países de latinoamerica se suspendió la distribución y comercialización de todos los medicamentos que contengan nimesulida por el riesgo de contraer una enfermedad en el hígado asociada al consumo de este medicamento. Un informe realizado por la Red de Centros de Información de Medicamentos de Latinoamérica y el Caribe (RedCIMLAC) se basó en una revisión de estudios clínicos, que comparaban el uso de nimesulida con otros antiinflamatorios, en los que se mostró la existencia de mayor riesgo de daño en el hígado a causa de nimesulida, documentándose setenta y cinco casos de pacientes con daño hepático por causa de este fármaco, diez de los cuales terminaron en muerte en Latinoamérica. El daño hepático provocado por la nimesulida no depende de la dosis administrada, es decir, es una reacción inusual que depende de la respuesta del paciente al medicamento y por ello considerado un daño difícilmente predecible. La nimesulida es un antiinflamatorio analgésico ...
Médicos creen que el proceso del cambio de medicamento a pacientes hipertensos en el Seguro Social por sustitutos no tiene el mismo mecanismo de acción.
- Obtener enlace
- X
- Correo electrónico
- Otras aplicaciones

Medicos del Sindicato de Médicos Trabajadores del Instituto Salvadoreño del Seguro Social (Simetrisss) denunciaron ayer que dicha institución está realizando el cambio del antihipertensivo Irbesartán Sandoz sin los protocolos adecuados, lo que podría generar una afectación a los pacientes hipertensos. Exigieron al Seguro Social que entregue otros medicamentos tipo “sartanes”, pues un cambio del mismo podría provocar efectos adversos en la salud de los pacientes hipertensos. Ademas señalaron que la autónoma está cambiando ese producto por medicamentos como Enelapril, Amlopidina y Nevibolol, los cuales no tienen los mecanismos de acción del Irbesartán. Los especialistas advirtieron, además, que el Irbesartán Sandoz es el único producto en el que se han encontrado trazas de las impurezas denominadas N-nitrosaminas, N-nitrosodimetilamina (NDMA) y Nnitrosodietilamina(NDEA), cuyo uso prolongado podría generar cáncer.
Que son las trazas de n-nitrosaminas y cual es el peligro de encontrarlos en los medicamentos y alimentos.
- Obtener enlace
- X
- Correo electrónico
- Otras aplicaciones
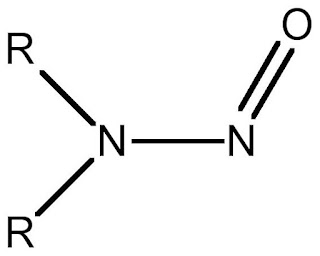
La alerta declarada por las diferentes Agencias Reguladoras por contaminación de “sartanes” tras haber detectado trazas de impurezas denominadas N-nitrosaminas, mismas que pueden producir cáncer, según la Agencia Internacional para la Investigación sobre Cáncer (IARC) de la Organización Mundial de la Salud (OMS). Los “sartanes” señalados en la alerta sanitaria son los Valsartan, Losartan, Irbesartan, Olmesartan y Candesartan, productos indicados a pacientes con hipertensión y fabricados por las empresas Zhejiang Huahai, Pharmaceutical Co. LTD, Zhejiang Tianyu Pharmaceutical Co. LTD y Hetero Labs Limited. Las N-nitrosaminas constituyen el grupo más relevante de los compuestos N-nitroso, como sustancias carcinogénicas. La exposición en el hombre a N-nitrosaminas preformadas exógenamente puede tener diversas procedencias. Las principales fuentes son la dieta, el tabaco, los cosméticos, productos farmacéuticos, compuestos químicos utilizados en la agricultur...
Caso Irbesartan: El Instituto Salvadoreño del Seguro Social (ISSS) cambiará el medicamento hipertensivo que tienen prescrito 100,000 pacientes.
- Obtener enlace
- X
- Correo electrónico
- Otras aplicaciones
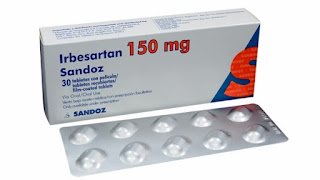
El Instituto Salvadoreño del Seguro Social (ISSS) cambiará el medicamento hipertensivo que tienen prescrito 100,000 pacientes, el fármaco es el Irbesartán y recientemente fue incluido en un listado de 54 medicamentos con detección de impurezas y con alerta internacional, ya que su uso prolongado podría provocar cáncer.Es Irbesartán Sandoz, presentación de 150 miligramos, es el que entrega el ISSS . Los medicamentos Sartanes se han detectado impurezas y que se producen durante la fabricación del principio activo … se señala dos fabricantes de origen Chino y uno Hindú. Nosotros revisamos la lista de medicamentos no aprobados y de los 53 (que se enumeran), el Irbesartán es el que se tiene en el Instituto; entonces responsablemente se procedió a montar un plan de acción para poder sustituir el medicamento a los pacientes,comentaban autoridades.La Dirección Nacional de Medicamentos (DNM) informó sobre la alerta médica recién esta semana . Informaron también que, según estudi...
Entradas populares de este blog
Pekemecum: una app para calcular las dosis correctas de 46 fármacos para el paciente pediátrico.
PeKemecum es una aplicación de utilidad clínica dirigida a los profesionales de la salud. Es una calculadora de dosificación de 46 fármacos en la edad pediátrica. Es una herramienta de ayuda al profesional, tanto en el ahorro del tiempo de cálculo como en la reducción de los posibles errores que puedan surgir de ello. En ésta primera versión se han incluido los principios activos más utilizados en la consulta de Atención Pediátrica. Para su desarrollo se ha basado en la información recogida de la ficha técnica de cada fármaco y en las guías publicadas por las diferentes Asociaciones de Pediatría y centros hospitalarios de referencia nacional. Durante el procesamiento de los datos, se han detectado discrepancias entre las diferentes guías e incluso en las mismas fichas técnicas acerca de la dosificación, intervalos horarios, contraindicaciones… Los datos utilizados en PeKemecum son el fruto del mayor consenso ofrecido entre las diferentes fuentes de información. Por las contraindicac...
La Historia de la Resistencia a las Cefalosporinas: Un Desafío en la Medicina.
Introducción Las cefalosporinas son un grupo de antibióticos β-lactámicos que han sido fundamentales en el tratamiento de diversas infecciones bacterianas. Sin embargo, con el paso del tiempo, la resistencia bacteriana a estos fármacos ha aumentado, representando un desafío para la salud pública global. Este artículo explora la historia de la resistencia a las cefalosporinas, sus mecanismos y las estrategias para contrarrestarla. 1. Descubrimiento y Desarrollo de las Cefalosporinas En 1945, el científico italiano Giuseppe Brotzu descubrió una sustancia producida por el hongo Acremonium (anteriormente Cephalosporium ), que mostraba actividad contra bacterias resistentes a la penicilina. Este hallazgo llevó al desarrollo de las cefalosporinas, que han evolucionado a lo largo de cinco generaciones, cada una con un espectro antimicrobiano más amplio y mejor estabilidad frente a β-lactamasas. 2. Mecanismos de Resistencia Las bacterias han desarrollado diversos mecanismos para evadir ...
Recomendaciones para prevenir el Dengue.
El Ministerio de Salud ha lanzado una campaña para evitar la multiplicación de casos de dengue. Son pasos sencillos y fáciles de seguir. Higiene en ciertos lugares de la casa Se recomienda lavar los bordes de las pilas y se sugiere que con un mascón (u otro utensilio) se laven barriles una vez por semana. Eliminar los depósitos que estén vacíos No acumular depósitos vacíos (botellas, latas, corcholatas, huacales, cascarones de huevo, estopas de coco) dentro y fuera de la casa. Desechar neumáticos que ya no sirven Salud exhorta a que las personas destruyan las llantas inservibles, o llenarlas con tierra para que no puedan acumular agua. Tomar medidas para prevenir enfermedad En las pilas y todos los depósitos con agua (como los barriles) se pide colocar bolsitas matalarvas, que pueden adquirirse gratis. Acudir al médico ante emergencia Si tiene fiebre, dolor de cabeza, no siente apetito y tiene dolor abdominal, el Ministerio de Salud recomienda consultar al m...


